来源:HIT专家网 作者:孙婧 整理
近日,从2025药品数智发展大会获悉,人工智能类医疗器械的研发与监管正迎来新趋势。我国已初步构建起覆盖全生命周期的AI医疗器械审评与监管框架,为企业产品申报和行业规范发展提供了有力支撑。
AI医疗器械监管,注重算法的可解释性
在监管方面,我国加强对算法更新控制的要求,依据更新类型实施分类管理,并通过软件版本命名规则进行有效管控。同时,强调算法泛化能力的保障,要求训练数据具备多样性和足够数量。
2025年,基于大模型的医疗AI产品大量出现,给监管带来新挑战。国家药监局与时俱进,对算法监管加强研究,并将着重从以下方面提升AI医疗器械产品的安全可控:
一是算法更新控制。根据算法更新类型区分要求,基于软件版本命名规则进行控制。
二是保证算法泛化能力。保证训练数据多样性,以及训练数据量;测试集异于训练集,注重临床测试数据多样性;加强真实世界性能数据监测。
三是提升黑盒算法可解释性。加强算法性能影响因素分析及比较分析;对软件生存周期过程质控以增强透明度;关注产品与医学知识的关联度,以实现白盒化。
目前,已逐步建立起AI医疗器械安全有效性评价体系。该体系涵盖质量体系核查、数字医疗审评通用要求(如软件、网络安全、移动计算、人因与可用性等),以及针对有源植入式医疗设备(AIMD)的通用与专用审评要求,覆盖CT肺炎、CT肺结节、糖网眼底照片、MR软件组件、超声软件组件、病理图像性能、病理图像临床、流式细胞学等多个专业领域。
人工智能医疗器械产业向好发展
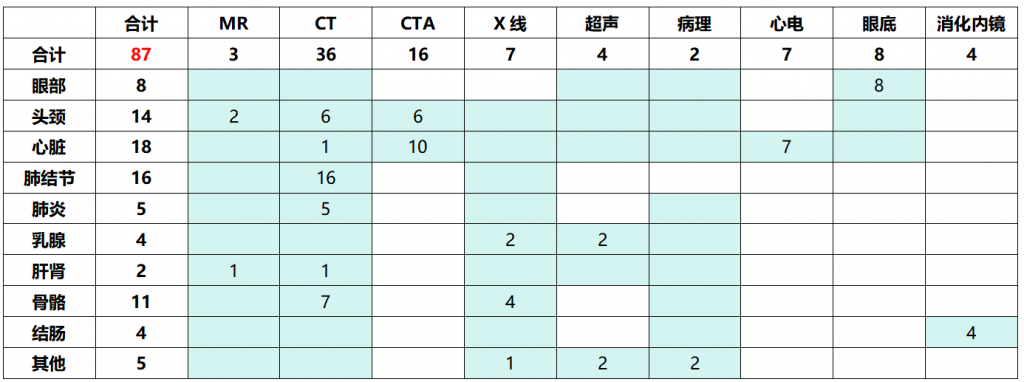
在产品获批方面,截至2024年4月,我国已批准医疗AI独立软件共87个,覆盖MR、CT、CTA、X线、超声、病理、心电、眼底、消化内镜等多个临床场景。其中,CT肺结节相关产品数量最多,达16个。
表:我国已批准医疗AI独立软件临床领域分布
随着技术不断发展,预计未来基于大模型的AI医疗产品将逐步涌现,推动医疗人工智能向更深层次应用迈进。

精彩不容错过!
【责任编辑:晓青】
 HIT专家网
HIT专家网




评论前必须登录!
注册